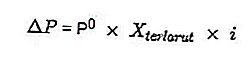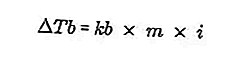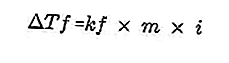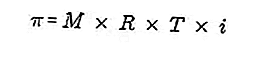Essayez de faire attention à ce qui nous entoure lié à la chimie? Le plus simple est l'air que nous respirons, qui contient un mélange d'oxygène, d'azote et d'autres gaz. Les assaisonnements alimentaires, le colorant alimentaire et les conservateurs alimentaires sont également d'autres exemples de produits chimiques qui nous entourent. La chimie est une branche des sciences naturelles que vous étudierez à l'école qui étudie divers matériaux, par exemple la structure de la matière, les propriétés de la matière, la forme du matériau, les changements dans la matière, la classification de la matière, la composition de la matière et l'énergie qui accompagnent ces changements. Non seulement les mathématiques et la physique, la chimie a également différents types de formules, vous savez. Il existe de nombreuses formules chimiques que vous étudierez, des propriétés colligatives aux réactions redox.
A cette occasion, nous apprendrons diverses formules chimiques ainsi que des exemples de problèmes qui vous aideront à comprendre les concepts de formules chimiques.
Formules chimiques et exemples de problèmes
La présence de formules en chimie a pour but d'aider les chercheurs à trouver différents types de résultats expérimentaux à réaliser. Pour bien maîtriser cette science, vous devez connaître certaines formules chimiques que vous rencontrerez souvent lors de vos études de chimie.
Formule des propriétés colligatives de la solution
Les propriétés colligatives d'une solution sont une nature de solution qui ne dépend pas d'un type de substance soluble, mais uniquement de la concentration des particules dans la solution. Ensuite, la nature colligative de la solution consiste en deux types de propriétés, à savoir la nature colligative de la solution électrolytique et la nature colligative de la solution non électrolytique.
- Propriétés colligatives des solutions non électrolytiques
Bien que la nature colligative implique une solution, la nature colligative ne dépend pas de l'interaction des molécules de soluté et de soluté, mais avec la quantité de soluté dissous dans une solution. Les propriétés colligatives consistent en une diminution de la pression de vapeur, une augmentation du point d'ébullition, une diminution du point de congélation et une pression osmotique. Chacun nécessite une formule chimique pour obtenir le résultat.
- Équation de perte de charge de vapeur

Source: formula.co.id
- Équation d'augmentation du point d'ébullition
Le point d'ébullition d'un liquide est la température fixe à laquelle il bout. À cette température, la pression de vapeur du liquide a une équation dans la pression de l'air autour de lui et est causée par l'évaporation de toutes les parties du liquide. Le point d'ébullition d'un liquide peut être mesuré par une pression de 1 atmosphère.
La différence entre le point d'ébullition d'une solution et le point d'ébullition d'un solvant pur est appelée augmentation du point d'ébullition, l'équation pour l'augmentation du point d'ébullition est:

Source: formula.co.id
- Équation de dérivation du point de congélation
Un soluté présent en solution rendra le point de congélation de la solution plus petit que le point de congélation du solvant. Équation de réduction du point de congélation:

Source: formula.co.id
- Pression osmotique
La pression osmotique est une force nécessaire pour équilibrer la pression du solvant de la membrane semi-perméable à travers la solution.
Une membrane semi-perméable est une membrane à travers laquelle les molécules de solvant peuvent passer, mais les solutés ne peuvent pas passer à travers. Selon Van't Hoff, à la pression osmotique, la solution est formulée comme suit:

Source: formula.co.id
- Propriétés colligatives des solutions électrolytiques
Dans la concentration, les propriétés colligatives de la même solution électrolytique ont une plus grande valeur lorsque nous la comparons aux propriétés colligatives de la solution non électrolytique. Parce que le grand nombre de particules de soluté résulte de la réaction d'ionisation de la solution d'électrolyte qui a été formulée dans le facteur Van't Hoff.
Le calcul des propriétés colligatives des solutions électrolytiques sera toujours multiplié par le facteur de Van't Hoff comme suit:

Source: formula.co.id
Certaines des formules pour les propriétés colligatives d'autres solutions d'électrolyte sont:
- Baisse de la pression de vapeur
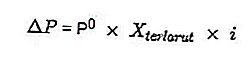
Source: formula.co.id
- Augmentation du point d'ébullition
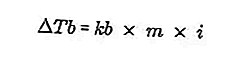
Source: formula.co.id
- Point de congélation
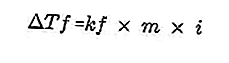
Source: formula.co.id
- Pression osmotique
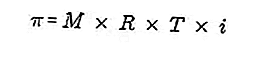
Source: formula.co.id
Formules de molarité, molalité et fraction molaire
Molarité (M)
La molarité est le nombre de moles d'une substance dissoute dans 1 litre de solution.

Source: formula.co.id
M = molarité
Mr = masse molaire du soluté (g / mol)
V = volume de solution
Molalité (m)
La molalité est le nombre de moles de la substance dissoute dans 1 kg de solvant. La formule chimique est la suivante.

Source: formula.co.id
m = molalité (mol / kg)
Mr = masse molaire du soluté (g / mol)
masse = masse du soluté (g)
P = masse de solvant (g)
Fraction mol
La fraction molaire est une unité de concentration dans laquelle tous les composants de la solution sont calculés en fonction des moles.

Source: formula.co.id
xi = nombre de moles
i, j, xj = fraction molaire
Exemples de problèmes de formule chimique
1. Si à la pression osmotique dans 500 ml de solution de fructose, C6H12O6 à partir de 32 ° C est de 2 atm, la masse de fructose dissous est?
Solution:

2. Dans la fraction molaire de solution d'urée dans l'eau 0,2. La pression de vapeur saturée de l'eau pure à une température de 20 ° C est de 17,5 mmHg. Alors à la solution la pression de vapeur saturée à la température suivante est?
X urée + X eau = 1
0,2 + X eau = 1
X eau = 0,8
Solution P = X eau x P eau
P de solution = 0,8 x 17,5 mmHg
P de solution = 14 mmHg
Voici quelques formules chimiques que vous pouvez apprendre pour vous permettre de répondre plus facilement à divers types de questions sur la chimie. Si vous pensez que ces formules ne suffisent pas, vous pouvez essayer le produit PROBLEM, une solution de pratique pondérée et complète en ligne pour la classe intelligente telle que la trigonométrie, la limite, le logarithme et bien d'autres. À partir du niveau élémentaire, du premier cycle du secondaire au secondaire avec diverses matières telles que les mathématiques, la physique, la chimie et autres. Ici, vous pouvez apprendre différents types de formules avec des exemples du problème.
Allez, qu'attendez-vous! Essayons dès maintenant les exercices PROBLÈME dans Smart Class.