Dans l'article précédent, nous avons discuté de ce qu'est une réaction redox. Les réactions redox couramment utilisées dans les domaines de la pharmacie, de la biologie, de l'industrie, de la métallurgie et de l'agriculture sont des types de réactions d'oxydation et de réduction qui se produisent simultanément. Lors d'une réaction redox, le nombre d'électrons perdus est égal au nombre d'électrons gagnés.
Les réactions redox consistent en des réactions de réduction et d'oxydation. La réduction est le processus d'élimination de l'oxygène ou des éléments électronégatifs d'une substance ou l'ajout d'hydrogène ou d'un élément électropositif à une substance. Pendant ce temps, l'oxydation est l'addition d'oxygène ou de tout élément électronégatif à une substance ou l'élimination de l'hydrogène ou de tout élément électropositif d'une substance.
Il existe plusieurs types de réactions redox que nous connaissons, y compris les réactions combinées, la décomposition, l'échange et la disproportionation.
Réaction combinée
Les réactions combinées sont des réactions lorsque deux ou plusieurs éléments se combinent pour former un seul composé.
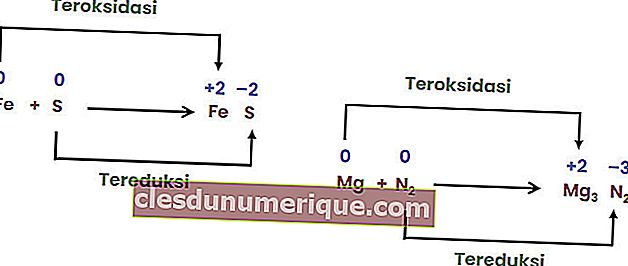
Réaction de décomposition
Une réaction de décomposition ou de décomposition est une réaction lorsqu'un composé se décompose ou se décompose en deux ou plusieurs substances ou éléments simples. Les réactions de décomposition sont communément appelées l'opposé des réactions combinées.
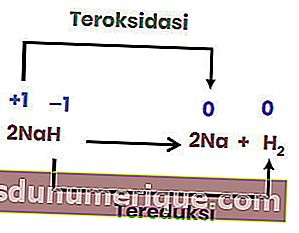
Cependant, toutes les réactions de décomposition ne sont pas des réactions redox. Un exemple est la réaction suivante.
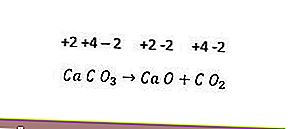
Puisqu'il n'y a pas de changement dans l'indice d'oxydation de chaque élément, la réaction ci-dessus n'est pas une réaction redox. Pour qu'une réaction de décomposition devienne une réaction redox, au moins un des composants formés doit être sous forme élémentaire.
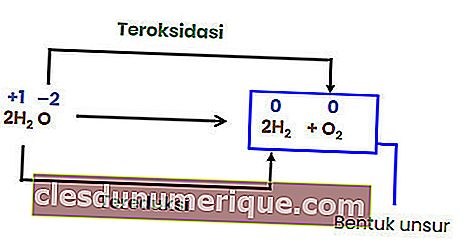
Réaction d'échange
Une réaction d'échange ou de remplacement est une réaction dans laquelle des atomes ou des ions dans un composé sont remplacés par des atomes ou des ions d'un autre composé. Les réactions de remplacement sont classées en remplacements métalliques et non métalliques.
(Lire aussi: En savoir plus sur les réactions redox)
Le remplacement du métal se produit lorsqu'un métal dans un composé est remplacé par un métal qui est plus réactif à l'état libre. Un exemple est la réaction ci-dessous.

Les réactions de remplacement de métal sont utiles dans les procédés métallurgiques lorsque du métal pur est obtenu à partir des composés présents dans le minerai.
Pendant ce temps, les réactions de remplacement non métalliques comprennent le remplacement de l'hydrogène, des halogènes et parfois de l'oxygène. Tous les métaux alcalins et certains métaux alcalino-terreux (Ca, Sr et Ba) remplacent l'hydrogène de l'eau froide. Un exemple peut être vu dans la réaction suivante.
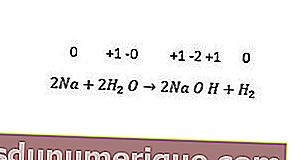
Réaction de disproportion
Le dernier type de réaction redox est la disproportion. Cette réaction se produit lorsque le même élément est simultanément oxydé et réduit. Les éléments ayant trois indices d'oxydation ou plus peuvent agir comme leurs propres agents oxydants et agents réducteurs. Un exemple est la réaction suivante.
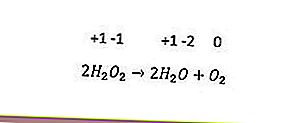
Dans la réaction ci-dessus, l'indice d'oxydation de l'oxygène (-1) est réduit à -2 et est oxydé à 0.









